(11) 熱力 ─ 補充
比熱 - 食物熱量測量儀器
彈式熱量計原理與常見疑問
簡單來說就是把食物丟進一個bomb,然後燃燒,之後bomb會釋放熱量,和周遭的水達到熱平衡,量水上升的溫度就知道該食物的熱量了。
測量流程
- 準備階段:
- 將乾燥的食物樣品放入金屬製的「氧彈」中。
- 將氧彈浸入裝有已知水量和溫度的絕緣水槽。此時水溫穩定,為測量基準。
- 化學反應階段:
- 透過點火啟動氧彈內的燃燒反應。
- 食物在高壓純氧環境下劇烈燃燒,將儲存在分子鍵結中的化學能,迅速轉化為熱能和光能。
- 這個過程是連續且同時發生的。
- 熱傳導階段:
- 高溫的氧彈會將燃燒產生的熱量傳導給周圍的水。
- 水溫隨之上升,直到食物完全燃燒且系統達到熱平衡後,測量最終的水溫。
自問的問題
-
燃燒是什麼?
燃燒的本質是一個快速的氧化還原反應,它將可燃物的化學能,轉化為熱能和光能。 白話解釋:燃燒就像一個能量「解鎖」過程。點火提供的熱量,讓食物分子(例如:碳水化合物)分解成氣態分子,並與氧氣結合。在這個結合的過程中,食物分子失去電子(氧化),並釋放出巨大的能量。
-
為什麼點火就能讓整份食物燃燒?
- 燃燒是一個連鎖反應。點火只是一個微小的「觸發點」,它將一部分食物加熱到燃點,讓這部分食物開始燃燒。
- 一旦燃燒開始,它會自己產生大量的熱量。這股熱量會向周圍傳導,預熱旁邊的食物,使其也達到燃點,進而引發下一波的燃燒。
- 這個過程不斷重複,直到所有食物都燃燒完畢。因此,我們測量的能量是來自食物本身,而非最初的點火。
-
點火造成的額外熱量會影響測量嗎?
不會。點火提供的能量相較於食物所釋放的巨大化學能,是微不足道的。它的作用僅是啟動反應,而非能量來源。
-
為什麼要用燃燒的方式來測量?
因為燃燒是一種最快速且徹底的氧化反應。它能夠完全將食物分子中的化學鍵拆解,從而釋放出所有能量。這種方式是目前最精準、最直接的物理測量法。
-
這個儀器如何避免熱量傳導造成的影響?
它沒有避開熱量傳導,而是利用熱傳導來測量。儀器的設計確保了食物燃燒所產生的熱能,最終都會透過熱傳導,轉移到水和儀器本身。我們正是藉由測量這個熱傳導的結果(水溫變化),來計算出食物的總熱量。
-
燃燒與人體消化的相似與相異?
- 相似點:兩者都是氧化反應,最終目的都是將食物分子中的化學鍵拆開,釋放出其中的能量。
- 相異點:
- 燃燒:是一個快速、劇烈的過程,在極短時間內將所有化學能轉化為熱能和光能。
- 消化:是一個緩慢、溫和的過程,由人體內的酵素逐步完成。能量是逐步釋放,並儲存為 ATP,供身體各個細胞使用。
總結
彈式熱量計的原理可以簡化為一個簡單的能量轉化鏈:食物化學能 → 燃燒過程 → 熱能(被水和儀器吸收) → 溫度上升
透過精確測量水溫的變化,我們就能反向推算出食物最初所蘊含的總能量。
凡德瓦方程式
理想氣體方程式只適用於低密度和高溫的真實氣體。但若是氣體密度增加,分子的尺寸以及分子間的交互作用就必須被考慮進去。 可以想一下,如果理想氣體方程式若還都滿足的話,那氣體可以被無限壓縮,永遠不會有液化的可能。
首先是分子的尺寸,由於分子的體積是有限的,可供分子移動的體積會小於容器的體積。因此,我們將 V 修正為有效體積$(V-b)$,譬如說一個房間要移動一個箱子,那麼該箱子可移動的範圍一定要排除自身的體積,那如果有很多個箱子的話,也不能移動到其他箱子在的地方。
接著是作用力,考慮凡德瓦力(分子和分子間的吸引力),對於靠近容器壁的分子,它會受到其他分子對他的吸引力,方向指向內部、遠離管壁,使得壓力變小。因為這個作用力來自分子,所以力的大小與氣體的密度成正比,加上靠近管壁的分子數量也與密度成正比,因此壓力可修正為$P=P′−a/V^2$
整理之後理想氣體經過凡德瓦修正
\[\left(P+\frac{a}{V^2}\right)(V-b) = RT\]然後就可以畫圖了。
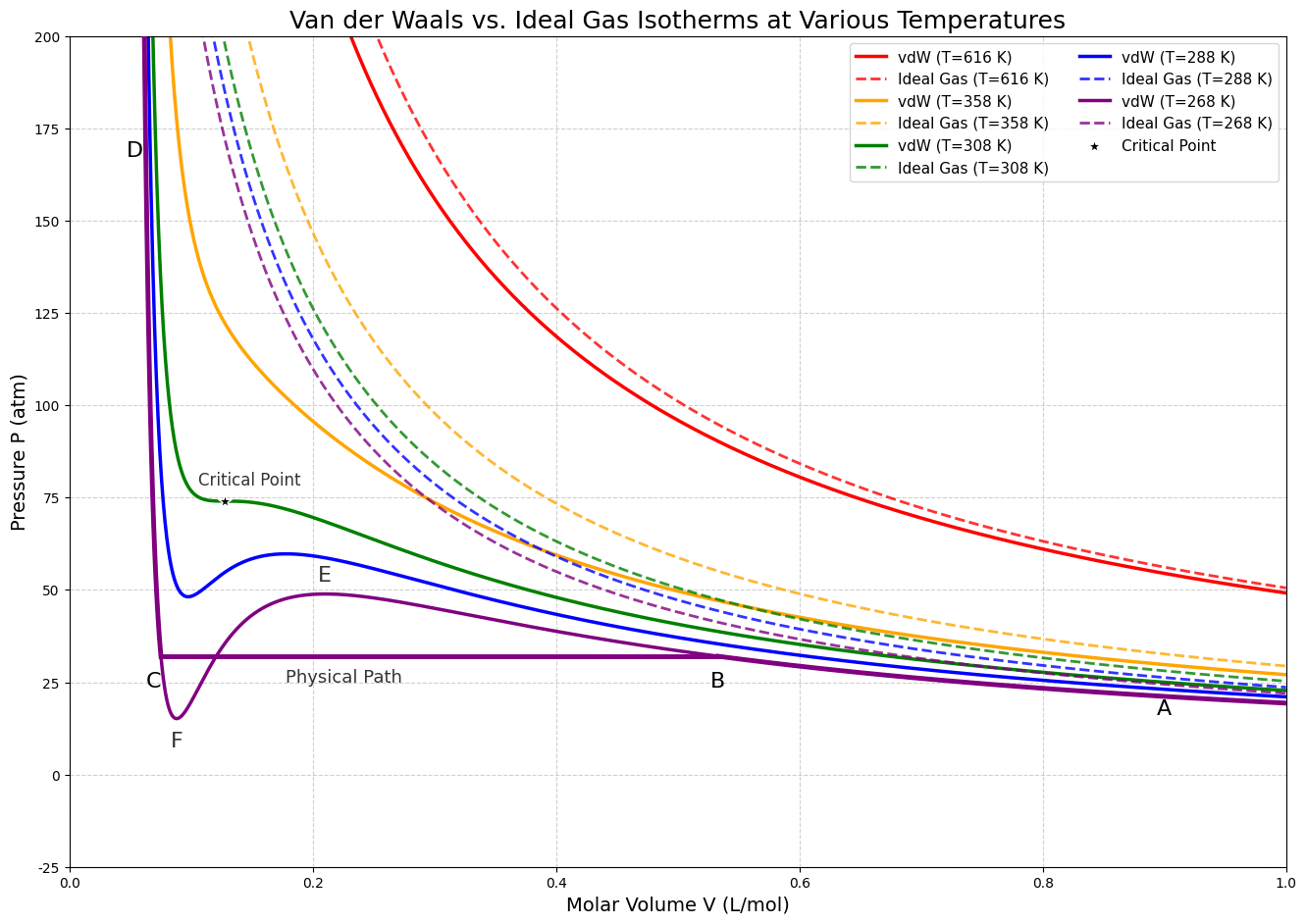
最上面那條是高溫下真實氣體的等溫線,在該溫度下,分子的熱動能遠大於凡德瓦吸引力,所以它的行為趨近於理想氣體方程式。越往下溫度越低凡德瓦的修正顯現,可以看到畫到critical point那條線時,已經有一個斜率為零的地方,此條等溫線可以當作是一個分界。
- critical point 以上:都是氣體
- critical point 以下:稱為蒸氣(差別在於此氣體可以被液化)
而在 A -> B -> C -> D 的過程中
- A->B:壓力持續上升,到B點液滴形成,氣體開始液化。
- B->C:壓力不變,容器內同時存在液體和蒸氣,蒸氣分子凝結成液體,液體分子也會蒸發成蒸氣,「凝結速率」等於「蒸發速率」,系統達到動態平衡(相平衡)。此時對應的壓力之所以維持定值(該溫度的飽和蒸氣壓),是因為壓縮體積時(活塞往下壓),雖然暫時增加蒸氣的密度,使得「凝結速率」大於「蒸發速率」,但是蒸氣轉變成液體後密度壓力又會下降回到原來的飽和蒸氣壓值,系統再次達到平衡。
- C->D:蒸氣都已凝結成液體。若進一步減小體積會沿著 CD 線導致壓力急遽上升,因為液體有很低的壓縮性。
另外完整的B->E->F->C也是凡德瓦方程式的解,但很不穩定,現實狀況應該是B->C。
- B->E:過冷蒸氣(Supercooled Vapor),壓力高於該溫度的飽和蒸汽壓,還沒有開始凝結的蒸汽,極不穩定,可能給個小灰塵就馬上液化了。
- C->F:過熱液體(Superheated Liquid),已經過了沸點但還沒開始沸騰,這時也很不穩定,給個小雜質就會突然沸騰了。
- E->F:現實不可能。
絕對零度
在Charles & Gay-Lussac的實驗中,發現不同理想氣體的VT圖外插後在溫度為攝氏-273.15時,V = 0,此溫度就是Kelvin tempearture T = 0 的絕對零度。
這個外插只是一個數學上的做法,因為其實實際氣體還沒到達這個溫度時就液化了。
對於這個部份我自己有幾個問題,問一下GPT&Gemini,這裡稍微紀錄一下
為什麼定壓情況下,溫度降到0,體積也會0,體積=0是什麼意思
理想氣體定律是理想化的物理模型,得到溫度為0時體積為0。但是體積為 0 在現實世界中是不可能的,它只是一個數學模型的推論結果。這個推論之所以在現實中不成立,原因如下:
-
氣體會相變(液化和固化): 理想氣體模型忽略了分子之間的吸引力。在溫度不斷降低的過程中,氣體分子的動能越來越小,它們之間的吸引力會開始起主導作用。在遠未達到絕對零度之前,所有真實氣體都會先液化,然後再固化。例如,氮氣在 -196°C 就變成了液體。一旦物質變成液體或固體,它就不再遵守理想氣體定律了,那條直線關係也就被破壞了。
-
分子本身有體積: 理想氣體模型假設組成氣體的分子是沒有體積的「質點」。但現實中,原子和分子是實實在在的粒子,它們本身就佔據空間。即使你把所有分子緊緊地堆疊在一起(像固體那樣),它們的總體積也不可能為零。這個體積就是原子和分子本身的體積之和。
所以,「體積 = 0」的真正意思是:
它是一個基於「理想氣體」這個簡化模型的數學外推結果,它預言了如果氣體分子是沒有體積且彼此間沒有吸引力的質點,那麼當它們的熱運動能量完全消失時,它們佔據的宏觀體積將會是零。
在現實中,這個「體積」指的是分子之間可供自由運動的空間。當溫度趨近於絕對零度時,是這個自由空間趨近於零,而不是分子本身的體積變成了零。
可是這樣的理想模型下,氣體的平均動能沒了(溫度=0),所以不再運動導致自由的空間體積為零,這時的理想模型要怎麼解釋還能維持定壓呢?
簡單的回答是:在理想模型的理論極限下,您無法同時維持「定壓」(一個非零的壓力)和「絕對零度」。這兩者是互斥的。
讓我們來詳細解釋為什麼會這樣:
- 壓力的來源是什麼?
在理想氣體模型中(或稱氣體動力論),壓力並不是一個靜態的力,而是由無數個氣體分子持續不斷地、高速地撞擊容器壁所產生的宏觀效果。
- 溫度越高 -> 分子運動速度越快 -> 撞擊力道越強、頻率越高 -> 壓力越大。
- 溫度越低 -> 分子運動速度越慢 -> 撞擊力道越弱、頻率越低 -> 壓力越小。
- 「定壓冷卻」過程的真相
現在,我們來分析您提到的「定壓情況下」。這通常是指在一個帶有活塞的容器中進行的實驗,活塞上有一個固定的重物,用來保持壓力恆定。
當我們開始冷卻這個系統時,會發生什麼事?
- 溫度下降:氣體分子的平均動能下降,運動變慢。
- 撞擊力減弱:因為分子變慢了,它們撞擊活塞的力量和頻率都減小了。這意味著內部的氣體壓力有下降的趨勢。
- 體積收縮:由於內部壓力暫時小於外部固定的壓力(大氣壓力+重物),活塞會被向下推。
- 壓力恢復平衡:活塞向下移動,使得容器體積變小。在更小的空間裡,即使分子運動變慢了,它們撞擊器壁的頻率會增加。這個「頻率增加」的效果補償了「力道減弱」的效果,使得內部壓力再次與外部壓力達成平衡。
- 所以,「定壓冷卻」的過程,實際上是體積不斷收縮,以補償因溫度降低而減弱的分子撞擊,從而勉強維持內外壓力相等的動態平衡過程。
- 矛盾點:當溫度來到絕對零度
現在,我們把這個過程推到理論極限——絕對零度(0 K)。
根據模型的定義,在 T = 0 K 時:
- 所有分子的動能為零。
- 所有分子完全停止運動。
- 如果分子完全不運動了,它們還會去撞擊容器壁嗎? 不會了。
- 沒有撞擊,就沒有壓力。
因此,在理想模型的理論中,當溫度達到絕對零度的瞬間,氣體的壓力必然會變為零。
結論:如何解釋這個矛盾? 您提出的「定壓」是一個前提條件,而「壓力為零」是達到絕對零度時的必然結果。這說明了這個前提條件在極限情況下是無法被維持的。
更精確的說法應該是:
在一個我們「試圖」維持壓力恆定的系統中,當溫度「趨近於」絕對零度時,我們觀察到體積也「趨近於」零。但在理論上到達絕對零度的那一刻,系統的內在屬性(分子停止運動)使得壓力必然為零,此時「定壓」這個外部條件就崩潰了。
外部的壓力(例如活塞上的重物)會把已經沒有任何內部壓力支撐的體積徹底壓垮到零(在模型中)。所以,在 T=0 K 時,系統的狀態是 P=0 且 V=0。
簡單比喻: 想像一群人在一個可以伸縮的房間裡亂跑亂撞,他們撞牆的力量就是「壓力」。我們要求牆壁受到的平均撞擊力(壓力)必須保持不變。
- 降溫:讓所有人都慢慢走,不要跑。
- 定壓:為了維持牆壁受到同樣的撞擊力,我們必須把房間的牆壁往內縮小。這樣,即使每個人走得慢,但他們撞到牆的次數變多了,總體壓力得以維持。
- 絕對零度:命令所有人「立正站好,不准動!」。
矛盾出現:一旦所有人都靜止了,他們就不可能再撞牆了。牆壁受到的力瞬間變成了零。這時,無論你把房間縮得多小,都不可能再產生任何壓力了。「維持定壓」這個指令,在此刻就無法執行了。
理想模型有這個矛盾,實務上又達不到,為何我們還會需要絕對零度的物理或數學概念存在呢?
簡單來說,絕對零度就像地圖上的「海平面」或數學中的「無限(∞)」。它是一個基準點、一個理論支柱和一個催生新發現的工具,其重要性不在於「抵達」,而在於它為我們提供了方向和意義。
以下是我們需要絕對零度這個概念的幾個關鍵原因:
- 它提供了一個絕對、統一的溫度基準(科學的通用語言)
日常使用的攝氏(°C)和華氏(°F)溫標都是「相對溫標」,它們的零點是人為定義的(例如水的冰點)。這在日常生活中很方便,但在科學計算中卻是個大問題。
- 問題:說「20°C 是 10°C 的兩倍熱」是錯誤的。因為溫度的本質是粒子動能,而 0°C 並不代表粒子沒有動能。
- 解決方案:以「絕對零度」為起點的開爾文溫標(K)是「絕對溫標」。0 K 是真正的零點,代表粒子能量的最低狀態。
- 意義:在開爾文溫標下,科學定律可以寫得非常簡潔優美。例如,理想氣體定律 PV=nRT 中的 T 必須使用開爾文溫度。只有這樣,「200 K 的能量才是 100 K 的兩倍」這句話才成立。絕對零度為所有熱力學計算提供了一個不容置疑的、放諸四海皆準的起點。
- 它是熱力學定律的基石 絕對零度的概念是熱力學第三定律的核心。這個定律有幾種表述方式,其中一種是:不可能透過有限的步驟,將任何物體的溫度降到絕對零度。
這聽起來像是在說「我們永遠到不了」,但它的物理意義遠不止於此:
定義了「熵」的絕對基準:第三定律指出,在絕對零度時,一個完美晶體的熵為零 (S=0)。熵是衡量系統混亂程度的物理量。有了這個「零點」,我們才能計算出任何溫度下物質的「絕對熵值」,這對化學反應方向的預測、材料科學等領域至關重要。
解釋了為什麼越冷越難冷:當你從一個物體中抽走熱量使其降溫時,物體本身能釋放的熱量會越來越少,抽熱的效率也會無限下降。熱力學第三定律從根本上解釋了這個現象,使我們理解了冷卻的極限。
- 它是通往未知物理世界的大門
雖然我們永遠無法「到達」絕對零度,但「逼近」它的過程卻催生了物理學中最前沿、最奇特的發現。科學家們在極低溫的環境下,觀察到了宏觀世界中絕不可能出現的量子效應。
- 超導性(Superconductivity):在極低溫下,某些材料的電阻會突然消失變為零,可以無損耗地傳輸電流。這是磁浮列車、核磁共振(MRI)等技術的基礎。
- 超流性(Superfluidity):液態氦在被冷卻到接近絕對零度時,會變成一種黏滯性為零的「超流體」,它可以無視重力向上攀爬容器壁,並能無摩擦地流動。
- 玻色—愛因斯坦凝聚(Bose-Einstein Condensate, BEC):當原子氣體被冷卻到僅僅比絕對零度高幾十億分之一度的程度時,所有原子會瞬間「凝聚」到同一個量子基態,表現得像一個巨大的「超級原子」。這是物質除了固、液、氣、電漿態之外的第五種形態。
如果沒有「絕對零度」這個目標在前方指引,科學家們可能永遠不會去探索極低溫的世界,這些革命性的發現也無從談起。
熱膨脹
從原子尺度看,就是他的位能井,一般來說平衡時,原子會待在最低位能處,就是原子的大小,但是當升溫時,原子開始震動(vibrate),如果位能井不是對稱的,這個整體平均位置就會落在比較寬的位置(右偏),就對應我們說的熱膨脹了。
熱傳導
固體和液體靠原子互相碰撞,傳遞vibrational energy。
\[\frac{dQ}{dt}=-\kappa A \frac{dT}{dx}\]$\kappa$: thermal conductivity.
熱對流
液體和氣體靠流動(mass transport)傳遞熱。
Forced convection 有外力介入引起對流。 Free convection 來自密度(隨溫度變化)
馬克士威 - 波茲曼速率分布
這個前面推導過了,這邊舉幾個特點
- 溫度越高,分布的高峰會往右移,波形更寬
- 速率最小是0,但最大是沒有限制的,波形也非對稱
- 地球大氣層的組成跟這有關,雖然氣體平均速率普遍低過地球逃逸速率,但在波形的右邊尾巴,有一小部分的速率非常快,容易達到逃逸速率而離開地球。而越輕的氣體,像是氫氣和氦氣,平均速率較高,也有更多的分布在波形右邊,超過逃逸速率而離開,較重的氣體則相反,所以我們的大氣層中氧氣和氮氣占比相對較多。而月球因為逃逸速率很低,所以氣體幾乎都跑光了,形成不了任何大氣層。
- 一般液體也有一樣的分布,有些分子有較高的動能所以可以克服跟其他分子的吸引力離開表面,就是我們說的蒸散(evaporation),剩下的平均動能比較低,所以溫度就下降了。
熱寂
熱力學第二定律我們常常說是”time’s arrow”,因為自然不可逆過程就是如此,整個宇宙就是越來越亂,總熵一直上升,直到一切都達到熱平衡(不在有熱交換和熵的變化)為止,我們稱為 heat death(熱寂)。
