(2) 熱力 ─ 溫度與熱平衡 & 熱力學第零定律
第一章我們提到人們常識知道兩個不同「溫度」的物體接觸後,會達到介於中間的「平衡溫度」。
這節就是來進一步了解所謂的「溫度」到底是指什麼?還有為什麼會達到中間的某種「平衡」狀態?
什麼是「狀態」與「平衡」?
首先,我們要描述一個系統時,可以用很多狀態變數 (state variables) 來描述,像是溫度($T$)、壓力($P$)、體積($V$)、質量($m$)或化學成分等等。
但只有在系統處於「平衡狀態 (Equilibrium State)」時,我們才能用一組單一的數值(例如 $P=1 \text{ atm}, T=300 \text{ K}$)來描述整個系統。
如果系統尚未平衡,這些變數在空間中是不均勻的。例如:
- 想像一個跟外面絕熱的系統(跟周遭沒有能量交換),裡面裝氣體在該容器上方壓一個塞子,靠近塞子的地方壓力會先增大,容器底部壓力比較小。
- 一樣的如果容器一邊被加熱,另外一邊一開始溫度不會變。
這些系統都需要「過一段時間」,讓壓力或溫度傳遞到整個系統,達到一個均勻、穩定的「平衡」狀態。
熱平衡直覺理解
那我們先來看熱平衡。
假設現在有兩個系統,一大一小,並且
\[T_2>T_1 (\Delta T \text{ is small})\]
問:若系統二很大,是個穩定熱庫,溫度不太會變化,那麼系統一的溫度隨時間會怎麼改變?
常識直覺應該就是長這樣
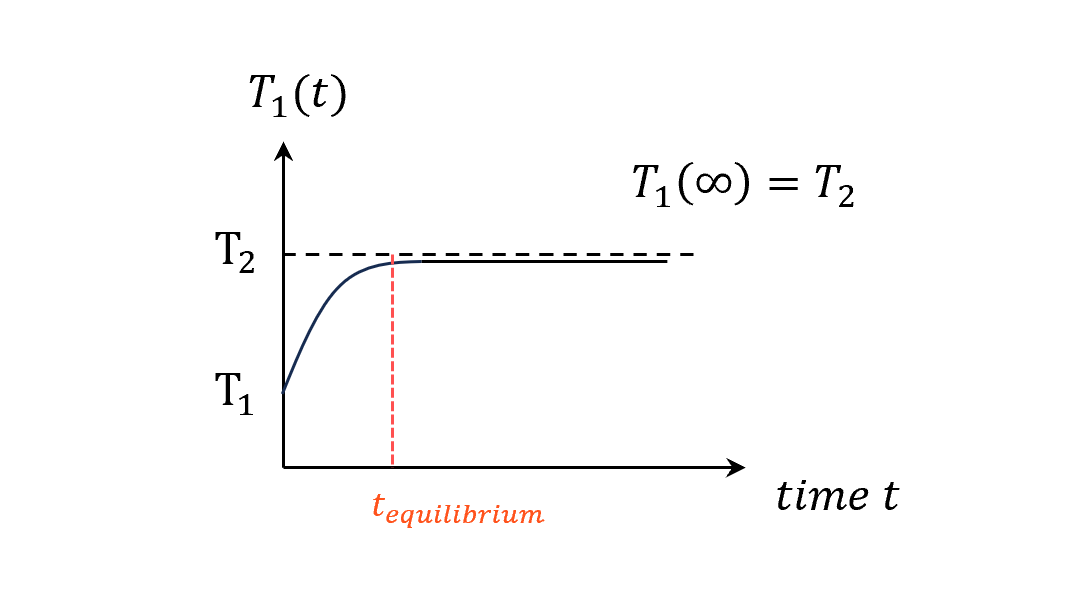
會有一個達成熱平衡(系統一溫度等於系統二溫度)的時間。
到這裡都很正常吧,我們把一顆球丟到超大盆熱水中,那顆球的溫度就會漸漸地跟水一樣。
但來靈魂拷問三個問題
- 為什麼我們稱兩個系統達成熱平衡的時候等價於兩個系統溫度一樣?
- 本質上是什麼物理量一樣?
- 為什麼會一樣?
兩個系統接觸時發生什麼事情?
現在用一個簡單的模型來看微觀上的碰撞(microscopic collisions),兩個系統中的氣體分子發生碰撞進行能量交換。
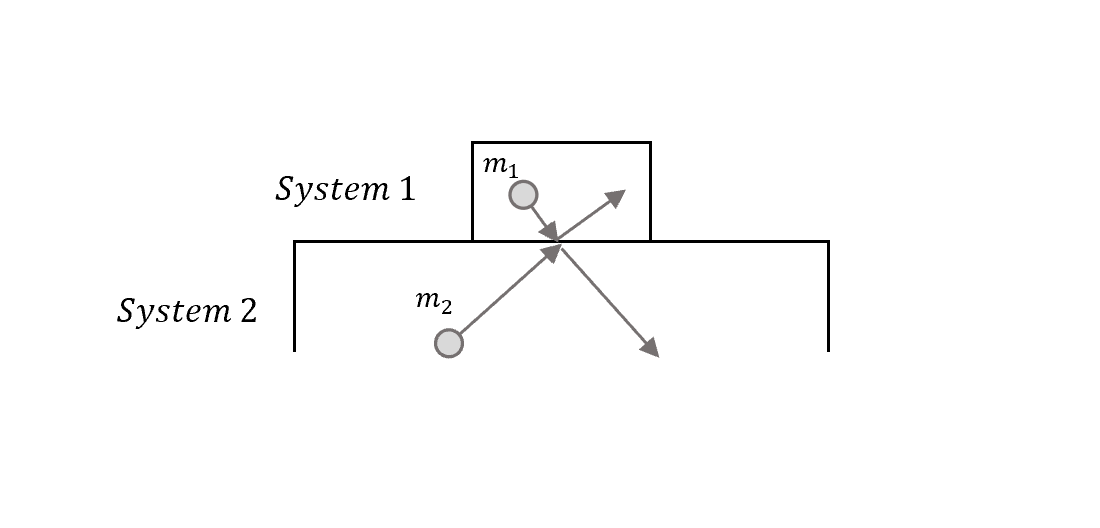
假設現在在一維,牛頓的動量守恆(彈性碰撞)告訴我們,碰撞後的速度
\[v_1'=\frac{m_1-m_2}{m_1+m_2}v_1+\frac{2m_2}{m_1+m_2}v_2\]所以系統一氣體分子在碰撞完之後的能量改變是
\[\Delta u_1=\frac{1}{2}m_1v_1'^2-\frac{1}{2}m_1v_1^2\\ =\frac{4m_1m_2}{(m_1+m_2)^2}\left[\frac{1}{2}m_2v_2^2-\frac{1}{2}m_1v_1^2+\frac{1}{2}(m_1-m_2)v_1v_2\right]\]又因每次碰撞能量的改變有正有負,所以我們取個平均來看
\[\langle \Delta u_1 \rangle = \frac{4m_1m_2}{(m_1+m_2)^2}\left[\Bigg\langle\frac{1}{2}m_2v_2^2\Bigg\rangle-\Bigg\langle\frac{1}{2}m_1v_1^2\Bigg\rangle\right]\]其中cross term沒了,因為這兩個系統彼此互相獨立,從統計上我們知道兩個獨立事件的平均值等於兩個相乘,那分開相乘各自有正有負,所以等於0。
\[\langle v_1 v_2 \rangle = \langle v_1 \rangle \langle v_2 \rangle = 0\]發生熱平衡
接著,當兩個系統藉由碰撞的能量交換平均起來是0的時候,我們就稱兩個系統達成熱平衡。
數學上表示
\[\langle \Delta u_1 \rangle = 0\]進而得出
\[\Rightarrow \Bigg\langle\frac{1}{2}m_2v_2^2\Bigg\rangle = \Bigg\langle\frac{1}{2}m_1v_1^2\Bigg\rangle\]代表的意思就是,當這兩個系統沒有互相推擠、體積沒有改變、巨觀上沒有具體的改變,只有在微觀上(碰撞)的能量交換時,達到熱平衡的意思就是每一個氣體分子的平均動能相等!
溫度指標描述
對於氣體分子的平均動能,我們進一步定義出溫度($k$是波茲曼常數):
\[\Bigg\langle\frac{1}{2}m_1v_1^2\Bigg\rangle \equiv \frac{1}{2}k T_1\\ \Bigg\langle\frac{1}{2}m_2v_2^2\Bigg\rangle \equiv \frac{1}{2}k T_2\\\]這兩個相等(熱平衡)就代表
\[T_1 = T_2\]溫度一樣!
所以回來前面的問題
- 為什麼我們稱兩個系統達成熱平衡的時候等價於兩個系統溫度一樣? 原本不同的兩個系統,碰撞完兩個系統中每個分子的平均動能相等就是達到熱平衡。而平均動能我們就定義為「溫度」,溫度因此就是個指標,每個系統有自己的溫度,熱平衡時兩個系統平均動能相等就是溫度相等。
- 本質上是什麼物理量一樣? 每個分子的平均動能
- 為什麼會一樣? 會達成熱平衡,是因為系統間會不斷進行能量交換,直到彼此每個粒子的平均動能都變得一樣為止。在這裡是用簡單的彈性碰撞模型推導出來(能量交換)。當然達成熱平衡的方式有非常多種,並非一定要是碰撞,但這是其中一個可以了解的最簡單方式,其他都只是推廣和變形而已。
注意的是我們這裡的熱平衡是微觀上的去解釋,但宏觀上因為描述一個系統的狀態變數很多,達到熱平衡時只能說兩者系統的溫度維持不變且相等,但各自的其他狀態變數(如壓力和體積)可能不同只是在平衡下(空間均勻)也維持不變。 Two systems are in thermal equilibrium with each other if their temperatures are the same.
溫度差和熱流方向
從前面的公式,我們把溫度代回去得到
\[\langle \Delta u_1 \rangle = \frac{4m_1m_2}{(m_1+m_2)^2}(T_2-T_1)\frac{1}{2}k\]中間那些都是常數,所以可以得到關係式
\[\langle \Delta u_1 \rangle \propto (T_2-T_1)\]以下討論三種狀況的溫度差
\[\begin{cases} T_2 > T_1\rightarrow \langle \Delta u_1 \rangle > 0\text{ (系統一得到能量,給的方式叫Q(Heat))}\\ T_1 > T_2\rightarrow \langle \Delta u_1 \rangle < 0\text{ (熱流反過來給系統二)}\\ T_2 = T_1\rightarrow \langle \Delta u_1 \rangle = 0\text{ (達到熱平衡)} \end{cases}\]可以看到溫度差和熱流的方向是有絕對性的關係,這也是我們平常更直覺的解釋方式
熱從高溫往低溫流!
實際系統溫度變化公式
那我們現在假設是第一個狀況,\(T_2 > T_1\),並且系統二很穩定,\(T_2\)為常數,求解\(T_1(t)\)。
首先一樣我們從兩個角度出發
1. 系統能量改變和溫差成正比
因為
\[\langle \Delta u_1 \rangle \propto (T_2-T_1)\]那麼單位時間能量的變化,就會和時間內發生幾次碰撞和每次碰撞時的能量變化有關係,所以得
\[\Bigg\langle \frac{du_1}{dt} \Bigg\rangle=f_\text{colli}\cdot \langle \Delta u_1 \rangle \propto (T_2-T_1)\]這裡一樣假設溫差不會太大,碰撞頻率趨近於常數。
2. 系統能量和溫度的變化
因為
\[\langle \Delta u_1 \rangle = \Bigg\langle\frac{1}{2}m_1v_1^2\Bigg\rangle = \frac{1}{2}k T_1\]那麼看單位時間能量的變化一樣得
\[\Bigg\langle \frac{du_1}{dt} \Bigg\rangle \propto \frac{dT_1}{dt}\]結合
結合兩個角度得到微分方程
\[\frac{dT_1(t)}{dt}=\gamma(T_2-T_1(t))\]其中$\gamma$因次是[1/time],接著我們就可以繼續求解$T_1(t)$囉!
定
\[x(t)\equiv T_1(t) - T_2\\ \Rightarrow \frac{dx}{dt}=\frac{dT_1}{dt}=-\gamma x\\ x(t)=x(0)e^{-\gamma t}=(T_1(0)-T_2)e^{-\gamma t}\\ T_1(t)=T_2+x(t)=T_2-(T_2-T_1(0))e^{-\gamma t}\]驗證一下得到這張圖

可以看到達到熱平衡的時間在溫差沒有太大的情況下都是一樣的,也就是說代表假設現在有一鍋100度$T_2$的水,你丟99度、98.5度的鐵球,達到熱平衡的時間都是一樣的!
熱力學第零定律
至此,我們有了熱平衡和溫度的概念,就可以來說明熱力學第零定律。
現在想像三個系統ABC,如果A和C達到熱平衡,B和C達到熱平衡,那A和B是否也熱平衡?
這個現在直接想會覺得不是廢話嗎,但其實不然,譬如說,如果C是磁鐵,AB是鐵釘,A和C相吸、B和C相吸,不代表A和B會相吸。
我們是經過實驗之後知道,A和B也會熱平衡,這就是熱力學第零運動定律。
Two bodies in thermal equilibrium with a third are also in thermal equilibrium with each other.
也是因為有這個的存在,我們才能用溫度計!
以剛剛的例子就是C是溫度計,當有了AC、BC的結果且C的讀數都一樣,我們不用真的再去做AB,也知道說AB若做熱接觸,一定會維持同樣溫度的熱平衡。
