(3) 熱力 ─ 從蒸汽機談起
在學熱力學的時候,通常起手就是畫一個容器,裡面有一堆氣體分子,旁邊有個活塞擋住,然後容器下面加熱,進而探討各種狀態和路徑。
但我想要先連結熱力學在日常上的應用,最好的簡單例子就是蒸汽機。
蒸汽機有很多種類,但共同原理就是:燃燒某種燃料(例如煤),產生的熱可以將周圍的水加熱至沸騰,產生的蒸汽推動活塞,活塞連結到的機械裝置(例如輪子)就可以跟著移動,活塞也來回移動,將熱能轉換為動能。
可以參考這個Youtube影片How Do Steam Locomotives Work - Steam Engines Explained

如此一來再回來看我們學熱力學常見的簡單模型就更有感覺了。接下來就針對這個模型(系統),先了解一些常用的名詞定義,下一節我們就會進展到熱力學第一定律了。
簡單系統
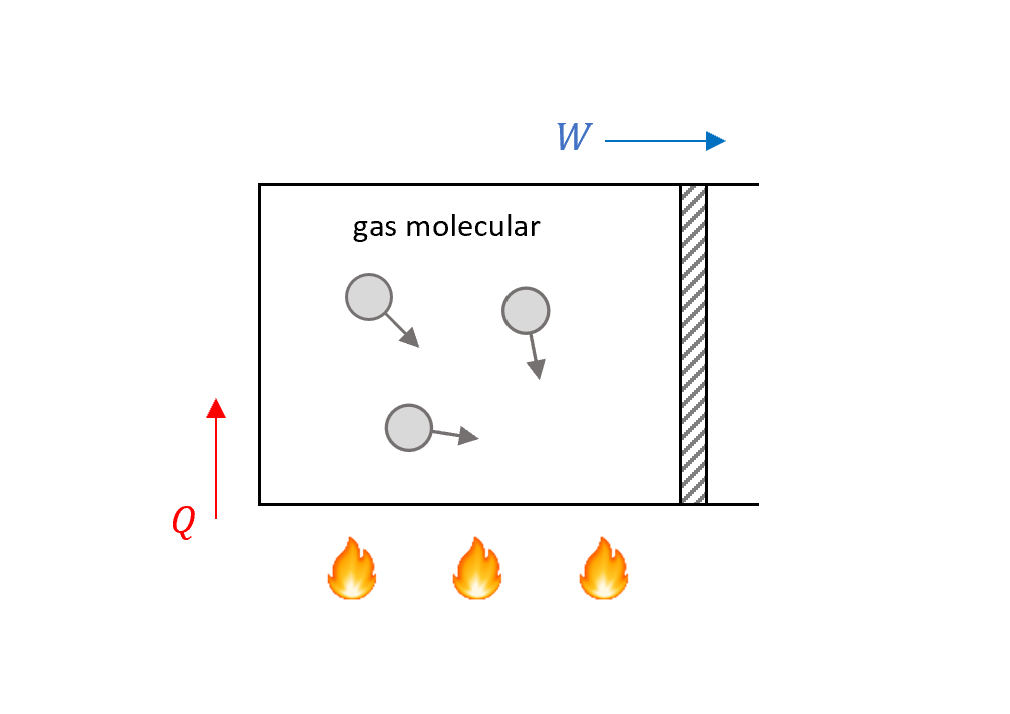
現在考慮有一盒氣體,開口處有活塞可以動,氣體可以對外面做功($W$)。
\[W:\text{work done by the gas}\]把這個系統放在火爐上加熱,底下會有熱量從火爐給氣體分子,在這裡我們定義$Q$正為吸熱,負會放熱
\[Q:\text{heat absorbed by the gas}\]系統名詞定義
熱庫
底下在加熱的火爐視為一個熱庫,熱庫的性質
- 擁有非常大的比熱。
- 大量熱可以流入流出,但不改變該系統溫度。
- 實際舉例:巨大湖泊、大氣層、一直被加熱的恆溫爐子
- 常見迷思:熱庫不是”含有很多的熱”,記住heat不是狀態含量(第一節)。
準靜系統 (quasistatic)
現在討論的熱力學系統是準靜系統,系統是氣體,外界環境就是包著的容器和活塞。
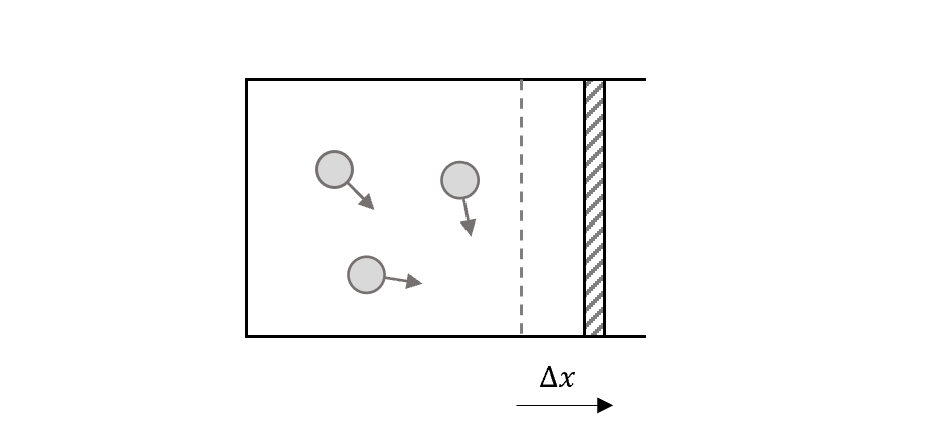
如果氣體膨脹,將活塞推出去,那就是氣體對外界作功,若這個系統和外界環境的熱力學變數$(P, V, T, n )$都變化地非常緩慢(infinitely slowly),就稱這個作功的過程為準靜的(quasistatic),代表系統任意時候都非常接近於平衡態(equilibrium state),可以由一組宏觀熱力學變數去定義和描述。
要達到這件事情,我們可以簡單想像譬如說活塞因為重力(或其他力),抵抗氣體的向外膨脹的壓力。如果活塞很快速地移動,那麼整個快速膨脹的過程就會有一些turbulence,局部狀態差異大,系統的壓力狀態就沒辦法被唯一定義下來。 (這種唯一的定義是說,整個系統每個空間的狀態都是一樣的,通常如果不是的話,對這個系統沒辦法只用某組特定數值定義)
不過實務上,其實也不是說真的要達到infinitely slowly,重點是過程每個階段都等到系統達到其平衡狀態,過程的時間尺度都能超過該系統自己達成平衡時需要的relaxation time。
作功
熱力學討論的作功是系統對外作功(external),定義方向為+,並不考慮系統內部自己作的功(internal)。
因此在準靜系統中,系統對活塞的作功就是
\[dW = Fdx = (PA) dx = PdV\]PV圖
因為準靜過程的P和V都能夠被唯一定義(uniquely defined),所以能畫個PV圖。
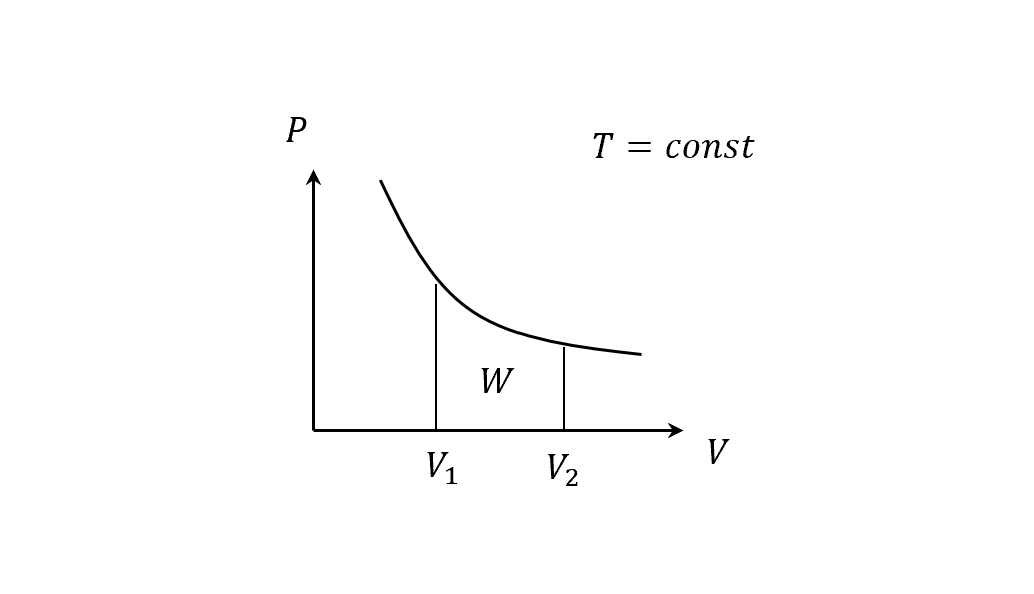
在 PV 圖上
- 一個「點」代表一個「狀態」,例如$P, V, T$和之後會提到的內能$U$。
- 一條「線」代表一個「過程」,例如$Q, W$,數值取決於經過的路徑,像是從平衡態(1)到另一平衡態(2)的過程,積分底下的面積就是系統對外的總作功了(這裡也很容易理解作功跟路徑過程有關)。
自由膨脹(Free Expansion)
相較於前面的準靜系統,現在就單純只有一個絕熱容器,不考慮外界環境。然後裡面用一個膜隔開空間,其中一個空間都裝著氣體。
若把膜戳破,氣體膨脹,但因為沒有之前的活塞,所以氣體沒有做任何的功,這就叫做free expansion。
實驗上,理想氣體在這樣的自由膨脹過程中,溫度不會變化。
可逆與不可逆
可逆過程的三大條件
- 必須是準靜過程
- 過程沒有摩擦力
- 熱交換必須在等溫且溫差趨近0條件下進行 (不然返回勢必要有其他做功,還不能100%返回)
現實生活中都是不可逆的,舉凡爆炸、擴散、傳導、化學反應等等,系統大部分會處在混亂的非平衡狀態,所以不能畫出PV圖,因為你根本不知道路徑應該會長什麼樣子。
而特別指出摩擦力的原因是,譬如我們搓手生熱,可以簡單分成兩部分,肌肉作功讓手(系統)提高系統內能(溫度),接者手和環境的溫差讓熱流向環境,手的溫度就會下來了,整個過程我們就稱為產生”廢熱”到環境中。
而會稱為這是廢熱的原因,則是若你想把這個環境的熱在拿回來,讓手回到原始的狀態,勢必得要再額外作功(就像是沒有完美冷機),改變系統(手)以外的環境狀態,所以整體來講並沒有辦法”可逆”如同影片倒帶一樣全部一起回到一樣的原始狀態。
最後第三點也是類似的道理,一旦兩個系統有顯而易見的溫差,那麼熱庫流向冷庫互相達成平衡之後,若要從冷庫在抽取熱回給熱庫讓兩者回到原始狀態,勢必得要有其他作功,改變了另外一個環境系統的狀態,所以是不可逆的。
理想氣體
氣體若遵守以下氣體方程式,我們就稱為理想氣體,現在系統內部的氣體通常假設為理想氣體(ideal gas),處理起來比較簡單,因為這個方程式就是簡單的線性關係。
現實中的氣體當然不會是這樣線性的關係,不過若現實的氣體密度夠低,沒有達到液化的溫度,那就可以用理想氣體方程式。
一般在大氣壓和室溫下的氣體可以近似於理想氣體。
理想氣體方程式
- Boyle:發現同溫度時PV成反比得到$PV=constant$
- Charles & Gay-Lussac:發現定壓時,體積和溫度成正比$V\propto T$;定容時,壓力和溫度成正比$P\propto T$
綜合結果,得到
\[PV=NkT\\ PV = nRT\]