(10) 熱力 ─ 小結
統計性
The macroscopic behavior of a system is the result of the statistical behavior of a large number of particles.
熱力學一些名詞定義
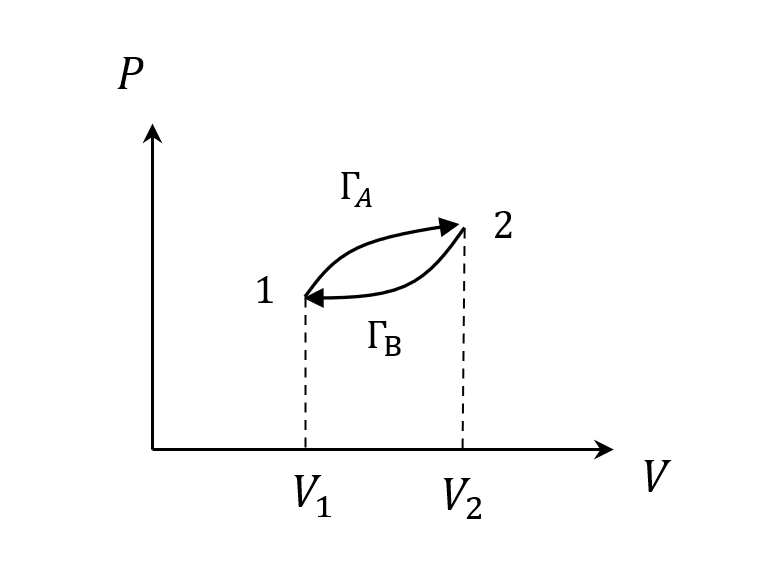
一個順時鐘的過程,$W_A > 0, W_B < 0$,淨做功 > 0,但因為回到初始狀態,所以
\(\Delta U = 0\\ Q=W\) –>
比熱
雖然比熱很直觀,表示一個物體上升一單位溫度時吸了多少熱量,公式可見第四章,但這裡再多了解一點歷史上是怎麼引進這個概念的。
彈式熱量計原理與常見疑問
簡單來說就是把食物丟進一個bomb,然後燃燒,之後bomb會釋放熱量,和周遭的水達到熱平衡,量水上升的溫度就知道該食物的熱量了。
測量流程
- 準備階段:
- 將乾燥的食物樣品放入金屬製的「氧彈」中。
- 將氧彈浸入裝有已知水量和溫度的絕緣水槽。此時水溫穩定,為測量基準。
- 化學反應階段:
- 透過點火啟動氧彈內的燃燒反應。
- 食物在高壓純氧環境下劇烈燃燒,將儲存在分子鍵結中的化學能,迅速轉化為熱能和光能。
- 這個過程是連續且同時發生的。
- 熱傳導階段:
- 高溫的氧彈會將燃燒產生的熱量傳導給周圍的水。
- 水溫隨之上升,直到食物完全燃燒且系統達到熱平衡後,測量最終的水溫。
自問的問題
-
燃燒是什麼?
燃燒的本質是一個快速的氧化還原反應,它將可燃物的化學能,轉化為熱能和光能。 白話解釋:燃燒就像一個能量「解鎖」過程。點火提供的熱量,讓食物分子(例如:碳水化合物)分解成氣態分子,並與氧氣結合。在這個結合的過程中,食物分子失去電子(氧化),並釋放出巨大的能量。
-
為什麼點火就能讓整份食物燃燒?
- 燃燒是一個連鎖反應。點火只是一個微小的「觸發點」,它將一部分食物加熱到燃點,讓這部分食物開始燃燒。
- 一旦燃燒開始,它會自己產生大量的熱量。這股熱量會向周圍傳導,預熱旁邊的食物,使其也達到燃點,進而引發下一波的燃燒。
- 這個過程不斷重複,直到所有食物都燃燒完畢。因此,我們測量的能量是來自食物本身,而非最初的點火。
-
點火造成的額外熱量會影響測量嗎?
不會。點火提供的能量相較於食物所釋放的巨大化學能,是微不足道的。它的作用僅是啟動反應,而非能量來源。
-
為什麼要用燃燒的方式來測量?
因為燃燒是一種最快速且徹底的氧化反應。它能夠完全將食物分子中的化學鍵拆解,從而釋放出所有能量。這種方式是目前最精準、最直接的物理測量法。
-
這個儀器如何避免熱量傳導造成的影響?
它沒有避開熱量傳導,而是利用熱傳導來測量。儀器的設計確保了食物燃燒所產生的熱能,最終都會透過熱傳導,轉移到水和儀器本身。我們正是藉由測量這個熱傳導的結果(水溫變化),來計算出食物的總熱量。
-
燃燒與人體消化的相似與相異?
- 相似點:兩者都是氧化反應,最終目的都是將食物分子中的化學鍵拆開,釋放出其中的能量。
- 相異點:
- 燃燒:是一個快速、劇烈的過程,在極短時間內將所有化學能轉化為熱能和光能。
- 消化:是一個緩慢、溫和的過程,由人體內的酵素逐步完成。能量是逐步釋放,並儲存為 ATP,供身體各個細胞使用。
總結
彈式熱量計的原理可以簡化為一個簡單的能量轉化鏈:食物化學能 → 燃燒過程 → 熱能(被水和儀器吸收) → 溫度上升
透過精確測量水溫的變化,我們就能反向推算出食物最初所蘊含的總能量。
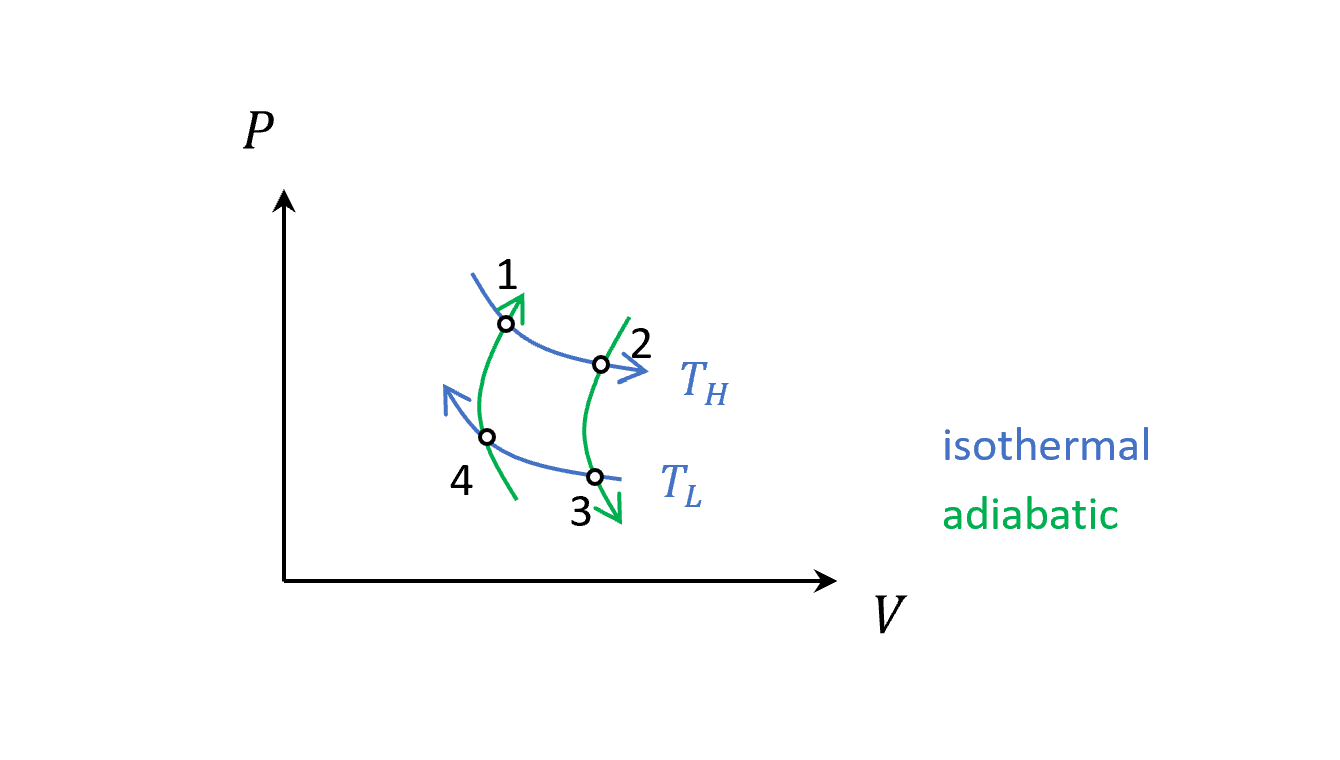
- 跟熱庫接觸,等溫膨脹,這時內能不變,氣體吸熱並對外做功。
- 熱庫被移除,系統在絕熱環境,然後做絕熱膨脹,對外做功,內能下降,溫度下降。
- 跟冷庫接觸,等溫壓縮,這時內能不變,氣體放熱並對內做功(壓縮)。
- 冷庫被移除,系統在絕熱環境,然後做絕熱壓縮,對內做功,內能上升,溫度上升。
若回到原點的封閉曲線,溫度不變,所以總對外做功為(圈起來的面積)
\[W=|Q_H|-|Q_C|\]而從之前第六節我們知道,算出來的熱機效率(卡諾效率)為
\[\epsilon_c=1-\frac{T_C}{T_H}\]只和冷庫和熱庫的溫度有關。
卡諾定理
第八節有證明過
- 所有可逆的熱機在同一溫度差的系統中效率都一樣,效率只和哪兩個熱庫的溫度有關係,和其中細節沒有關係。
- 沒有任何熱機的效率可以好過卡諾引擎(可逆)。 –>
熱膨脹
從原子尺度看,就是他的位能井,一般來說平衡時,原子會待在最低位能處,就是原子的大小,但是當升溫時,原子開始震動(vibrate),如果位能井不是對稱的,這個整體平均位置就會落在比較寬的位置(右偏),就對應我們說的熱膨脹了。
凡德瓦方程式
理想氣體方程式只適用於低密度和高溫的真實氣體。但若是氣體密度增加,分子的尺寸以及分子間的交互作用就必須被考慮進去。 可以想一下,如果理想氣體方程式若還都滿足的話,那氣體可以被無限壓縮,永遠不會有液化的可能。
首先是分子的尺寸,由於分子的體積是有限的,可供分子移動的體積會小於容器的體積。因此,我們將 V 修正為有效體積$(V-b)$,譬如說一個房間要移動一個箱子,那麼該箱子可移動的範圍一定要排除自身的體積,那如果有很多個箱子的話,也不能移動到其他箱子在的地方。
接著是作用力,考慮凡德瓦力(分子和分子間的吸引力),對於靠近容器壁的分子,它會受到其他分子對他的吸引力,方向指向內部、遠離管壁,使得壓力變小。因為這個作用力來自分子,所以力的大小與氣體的密度成正比,加上靠近管壁的分子數量也與密度成正比,因此壓力可修正為$P=P′−a/V^2$
整理之後理想氣體經過凡德瓦修正
\[\left(P+\frac{a}{V^2}\right)(V-b) = RT\]然後就可以畫圖了。
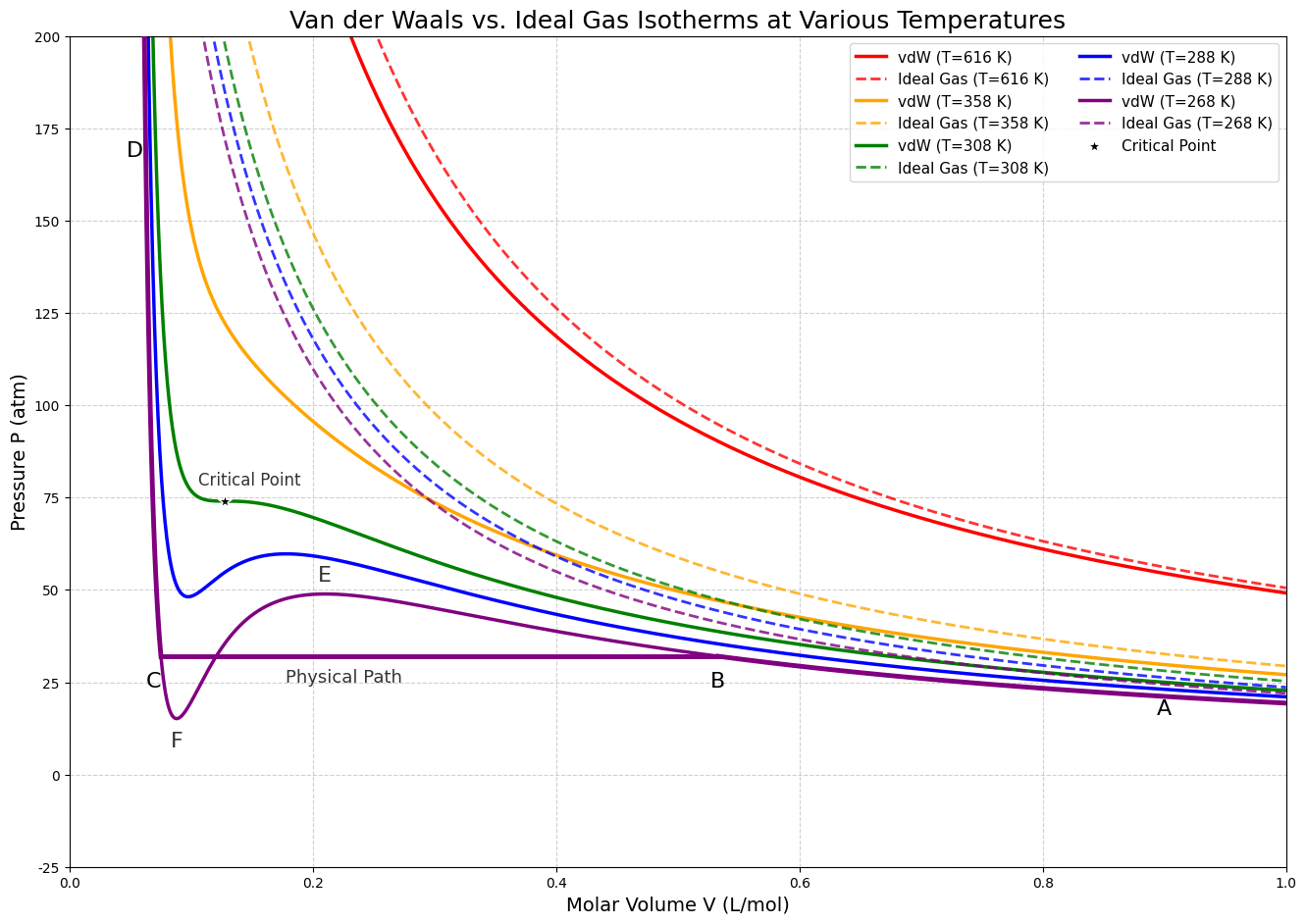
最上面那條是高溫下真實氣體的等溫線,在該溫度下,分子的熱動能遠大於凡德瓦吸引力,所以它的行為趨近於理想氣體方程式。越往下溫度越低凡德瓦的修正顯現,可以看到畫到critical point那條線時,已經有一個斜率為零的地方,此條等溫線可以當作是一個分界。
- critical point 以上:都是氣體
- critical point 以下:稱為蒸氣(差別在於此氣體可以被液化)
而在 A -> B -> C -> D 的過程中
- A->B:壓力持續上升,到B點液滴形成,氣體開始液化。
- B->C:壓力不變,容器內同時存在液體和蒸氣,蒸氣分子凝結成液體,液體分子也會蒸發成蒸氣,「凝結速率」等於「蒸發速率」,系統達到動態平衡(相平衡)。此時對應的壓力之所以維持定值(該溫度的飽和蒸氣壓),是因為壓縮體積時(活塞往下壓),雖然暫時增加蒸氣的密度,使得「凝結速率」大於「蒸發速率」,但是蒸氣轉變成液體後密度壓力又會下降回到原來的飽和蒸氣壓值,系統再次達到平衡。
- C->D:蒸氣都已凝結成液體。若進一步減小體積會沿著 CD 線導致壓力急遽上升,因為液體有很低的壓縮性。
另外完整的B->E->F->C也是凡德瓦方程式的解,但很不穩定,現實狀況應該是B->C。
- B->E:過冷蒸氣(Supercooled Vapor),壓力高於該溫度的飽和蒸汽壓,還沒有開始凝結的蒸汽,極不穩定,可能給個小灰塵就馬上液化了。
- C->F:過熱液體(Superheated Liquid),已經過了沸點但還沒開始沸騰,這時也很不穩定,給個小雜質就會突然沸騰了。
- E->F:現實不可能。
絕對零度
在Charles & Gay-Lussac的實驗中,發現不同理想氣體的VT圖外插後在溫度為攝氏-273.15時,V = 0,此溫度就是Kelvin tempearture T = 0 的絕對零度。
這個外插只是一個數學上的做法,因為其實實際氣體還沒到達這個溫度時就液化了。
對於這個部份我自己有幾個問題,問一下GPT&Gemini,這裡稍微紀錄一下
為什麼定壓情況下,溫度降到0,體積也會0,體積=0是什麼意思
理想氣體定律是理想化的物理模型,得到溫度為0時體積為0。但是體積為 0 在現實世界中是不可能的,它只是一個數學模型的推論結果。這個推論之所以在現實中不成立,原因如下:
-
氣體會相變(液化和固化): 理想氣體模型忽略了分子之間的吸引力。在溫度不斷降低的過程中,氣體分子的動能越來越小,它們之間的吸引力會開始起主導作用。在遠未達到絕對零度之前,所有真實氣體都會先液化,然後再固化。例如,氮氣在 -196°C 就變成了液體。一旦物質變成液體或固體,它就不再遵守理想氣體定律了,那條直線關係也就被破壞了。
-
分子本身有體積: 理想氣體模型假設組成氣體的分子是沒有體積的「質點」。但現實中,原子和分子是實實在在的粒子,它們本身就佔據空間。即使你把所有分子緊緊地堆疊在一起(像固體那樣),它們的總體積也不可能為零。這個體積就是原子和分子本身的體積之和。
所以,「體積 = 0」的真正意思是:
它是一個基於「理想氣體」這個簡化模型的數學外推結果,它預言了如果氣體分子是沒有體積且彼此間沒有吸引力的質點,那麼當它們的熱運動能量完全消失時,它們佔據的宏觀體積將會是零。
在現實中,這個「體積」指的是分子之間可供自由運動的空間。當溫度趨近於絕對零度時,是這個自由空間趨近於零,而不是分子本身的體積變成了零。
可是這樣的理想模型下,氣體的平均動能沒了(溫度=0),所以不再運動導致自由的空間體積為零,這時的理想模型要怎麼解釋還能維持定壓呢?
簡單的回答是:在理想模型的理論極限下,您無法同時維持「定壓」(一個非零的壓力)和「絕對零度」。這兩者是互斥的。
讓我們來詳細解釋為什麼會這樣:
- 壓力的來源是什麼?
在理想氣體模型中(或稱氣體動力論),壓力並不是一個靜態的力,而是由無數個氣體分子持續不斷地、高速地撞擊容器壁所產生的宏觀效果。
- 溫度越高 -> 分子運動速度越快 -> 撞擊力道越強、頻率越高 -> 壓力越大。
- 溫度越低 -> 分子運動速度越慢 -> 撞擊力道越弱、頻率越低 -> 壓力越小。
- 「定壓冷卻」過程的真相
現在,我們來分析您提到的「定壓情況下」。這通常是指在一個帶有活塞的容器中進行的實驗,活塞上有一個固定的重物,用來保持壓力恆定。
當我們開始冷卻這個系統時,會發生什麼事?
- 溫度下降:氣體分子的平均動能下降,運動變慢。
- 撞擊力減弱:因為分子變慢了,它們撞擊活塞的力量和頻率都減小了。這意味著內部的氣體壓力有下降的趨勢。
- 體積收縮:由於內部壓力暫時小於外部固定的壓力(大氣壓力+重物),活塞會被向下推。
- 壓力恢復平衡:活塞向下移動,使得容器體積變小。在更小的空間裡,即使分子運動變慢了,它們撞擊器壁的頻率會增加。這個「頻率增加」的效果補償了「力道減弱」的效果,使得內部壓力再次與外部壓力達成平衡。
- 所以,「定壓冷卻」的過程,實際上是體積不斷收縮,以補償因溫度降低而減弱的分子撞擊,從而勉強維持內外壓力相等的動態平衡過程。
- 矛盾點:當溫度來到絕對零度
現在,我們把這個過程推到理論極限——絕對零度(0 K)。
根據模型的定義,在 T = 0 K 時:
- 所有分子的動能為零。
- 所有分子完全停止運動。
- 如果分子完全不運動了,它們還會去撞擊容器壁嗎? 不會了。
- 沒有撞擊,就沒有壓力。
因此,在理想模型的理論中,當溫度達到絕對零度的瞬間,氣體的壓力必然會變為零。
結論:如何解釋這個矛盾? 您提出的「定壓」是一個前提條件,而「壓力為零」是達到絕對零度時的必然結果。這說明了這個前提條件在極限情況下是無法被維持的。
更精確的說法應該是:
在一個我們「試圖」維持壓力恆定的系統中,當溫度「趨近於」絕對零度時,我們觀察到體積也「趨近於」零。但在理論上到達絕對零度的那一刻,系統的內在屬性(分子停止運動)使得壓力必然為零,此時「定壓」這個外部條件就崩潰了。
外部的壓力(例如活塞上的重物)會把已經沒有任何內部壓力支撐的體積徹底壓垮到零(在模型中)。所以,在 T=0 K 時,系統的狀態是 P=0 且 V=0。
簡單比喻: 想像一群人在一個可以伸縮的房間裡亂跑亂撞,他們撞牆的力量就是「壓力」。我們要求牆壁受到的平均撞擊力(壓力)必須保持不變。
- 降溫:讓所有人都慢慢走,不要跑。
- 定壓:為了維持牆壁受到同樣的撞擊力,我們必須把房間的牆壁往內縮小。這樣,即使每個人走得慢,但他們撞到牆的次數變多了,總體壓力得以維持。
- 絕對零度:命令所有人「立正站好,不准動!」。
矛盾出現:一旦所有人都靜止了,他們就不可能再撞牆了。牆壁受到的力瞬間變成了零。這時,無論你把房間縮得多小,都不可能再產生任何壓力了。「維持定壓」這個指令,在此刻就無法執行了。
理想模型有這個矛盾,實務上又達不到,為何我們還會需要絕對零度的物理或數學概念存在呢?
簡單來說,絕對零度就像地圖上的「海平面」或數學中的「無限(∞)」。它是一個基準點、一個理論支柱和一個催生新發現的工具,其重要性不在於「抵達」,而在於它為我們提供了方向和意義。
以下是我們需要絕對零度這個概念的幾個關鍵原因:
- 它提供了一個絕對、統一的溫度基準(科學的通用語言)
日常使用的攝氏(°C)和華氏(°F)溫標都是「相對溫標」,它們的零點是人為定義的(例如水的冰點)。這在日常生活中很方便,但在科學計算中卻是個大問題。
- 問題:說「20°C 是 10°C 的兩倍熱」是錯誤的。因為溫度的本質是粒子動能,而 0°C 並不代表粒子沒有動能。
- 解決方案:以「絕對零度」為起點的開爾文溫標(K)是「絕對溫標」。0 K 是真正的零點,代表粒子能量的最低狀態。
- 意義:在開爾文溫標下,科學定律可以寫得非常簡潔優美。例如,理想氣體定律 PV=nRT 中的 T 必須使用開爾文溫度。只有這樣,「200 K 的能量才是 100 K 的兩倍」這句話才成立。絕對零度為所有熱力學計算提供了一個不容置疑的、放諸四海皆準的起點。
- 它是熱力學定律的基石 絕對零度的概念是熱力學第三定律的核心。這個定律有幾種表述方式,其中一種是:不可能透過有限的步驟,將任何物體的溫度降到絕對零度。
這聽起來像是在說「我們永遠到不了」,但它的物理意義遠不止於此:
定義了「熵」的絕對基準:第三定律指出,在絕對零度時,一個完美晶體的熵為零 (S=0)。熵是衡量系統混亂程度的物理量。有了這個「零點」,我們才能計算出任何溫度下物質的「絕對熵值」,這對化學反應方向的預測、材料科學等領域至關重要。
解釋了為什麼越冷越難冷:當你從一個物體中抽走熱量使其降溫時,物體本身能釋放的熱量會越來越少,抽熱的效率也會無限下降。熱力學第三定律從根本上解釋了這個現象,使我們理解了冷卻的極限。
- 它是通往未知物理世界的大門
雖然我們永遠無法「到達」絕對零度,但「逼近」它的過程卻催生了物理學中最前沿、最奇特的發現。科學家們在極低溫的環境下,觀察到了宏觀世界中絕不可能出現的量子效應。
- 超導性(Superconductivity):在極低溫下,某些材料的電阻會突然消失變為零,可以無損耗地傳輸電流。這是磁浮列車、核磁共振(MRI)等技術的基礎。
- 超流性(Superfluidity):液態氦在被冷卻到接近絕對零度時,會變成一種黏滯性為零的「超流體」,它可以無視重力向上攀爬容器壁,並能無摩擦地流動。
- 玻色—愛因斯坦凝聚(Bose-Einstein Condensate, BEC):當原子氣體被冷卻到僅僅比絕對零度高幾十億分之一度的程度時,所有原子會瞬間「凝聚」到同一個量子基態,表現得像一個巨大的「超級原子」。這是物質除了固、液、氣、電漿態之外的第五種形態。
如果沒有「絕對零度」這個目標在前方指引,科學家們可能永遠不會去探索極低溫的世界,這些革命性的發現也無從談起。
氣體動力學模型
模型對氣體中的分子做出假設:
-
氣體由大量完全相同的分子組成,這些分子以隨機的速度運動。
-
分子本身沒有內在結構(no internal structure),因此它們所有的動能都純粹是平移動能 (translational)。
-
除了與其他分子及容器壁發生短暫的彈性碰撞外,分子之間不發生交互作用,所以只有在非常近的距離下才有強排斥力。每次碰撞的持續時間遠短於兩次碰撞之間的時間間隔,因此與這些力相關的位能 (potential energy) 可以忽略。
-
分子之間的平均距離遠大於其自身的直徑。這表示分子本身所佔據的體積,相對於容器的總體積來說可忽略。(從液體的不可壓縮性我們可以推斷,液體中的分子幾乎是盡可能地緊密靠在一起。由於氣體的密度大約是液體密度的$10^{−3}$,因此在常溫常壓下,氣體分子間的平均距離大約是10個原子直徑,這個假設是合理的。)
-
為求簡化,我們同時也假設沒有外力(e.g., 重力)作用。
-
假設分子的整體速率分佈不隨時間改變——儘管個別分子的速率會因為碰撞而不斷改變。
在實務上,這些假設對於低密度且溫度遠高於其液化(沸騰)點的真實氣體是有效的。
自問的問題
-
為什麼每次碰撞的持續時間遠短於兩次碰撞之間的時間間隔,因此與這些力相關的位能 (potential energy) 可以忽略?
想像分子與分子之間的作用力,就像是彈簧,兩個分子就像是連結在兩側的木塊。當它們隨機運動、距離很遠的時候,各自都帶有動能,但彼此間的位能為零。一旦互相靠得太近發生彈性碰撞,這個抽象的彈簧就被壓縮,壓縮的過程會將系統的一部分動能,儲存為彈性位能。但因為這個過程極其短暫,彈簧很快又將兩個分子彈開,儲存的位能就100%歸還,轉變回系統的總動能,分子再度分開,位能再次歸零。
-
為什麼可以用彈簧當作表示?這裡的分子間作用力是什麼?為什麼可以用彈性碰撞來描述?
分子靠近時,靜電排斥力和包力不相容排斥會阻止兩個分子進一步靠近,其排斥力會超過一般較弱的凡得瓦力吸引力。這個在距離很近突然增大的排斥力,特性可以像是極具壓縮剛硬的彈簧(越壓縮、反抗越大),而彈性碰撞的定義是系統的總動能在碰撞其後保持不變,所以對於理想氣體分子,我們假設兩個分子碰撞後能量幾乎沒有以熱能或其他形式消散掉,短暫儲存的位能幾乎返還為動能,所以可近似於彈性碰撞。
-
為什麼要特別強調不考慮位能?考慮了又如何?
一般來說,氣體的總內能是動能(KE)+總位能(PE)。 現在定義理想氣體的PE=0,這樣才能讓理想氣體的內能僅是溫度的函數,因為溫度就是分子平均動能的宏觀體現。 如果考慮了位能,就如同”絕熱自由膨脹”一節說的,內能就會變得是和壓力(體積)及溫度有關的函數,是真實氣體的領域。
Heat Transport
熱傳導
固體和液體靠原子互相碰撞,傳遞vibrational energy。
\[\frac{dQ}{dt}=-\kappa A \frac{dT}{dx}\]$\kappa$: thermal conductivity.
熱對流
液體和氣體靠流動(mass transport)傳遞熱。
Forced convection 有外力介入引起對流。 Free convection 來自密度(隨溫度變化)
熱輻射
氣體動力論
前面已經提到過,熱力學Thermodynamics是處理宏觀的物理量(壓力、體積、溫度),但無法告訴你微觀的細節。而氣體動力論(Kintetic Theory)就是想知道這些微觀上發生了什麼事情。
在氣體動力論中,我們假設氣體是由非常大量的、會隨機移動且頻繁碰撞的分子所組成,譬如說在標準大氣壓力與室溫下,1立方公分的氣體大約含有$3×10 ^19$個分子,雖然我們不可能把每個分子都用牛頓力學去描述(自由度太高,太難解,如第七節),但我們可以取微觀下的平均值來表達宏觀的狀態。
理想氣體模型
見上面理想氣體章節。
壓力解釋
在17世紀,認為氣體壓力來自於粒子之間的排斥力,加上當時的熱質說(caloric),氣體吸收熱(caloric),會讓熱質粒子互相排斥變強,向外推擠成為氣體壓力上升的原因。
但我們已經說過熱質說後來被推翻,壓力正確的解釋方式是用熱與粒子的運動的關聯性,也就是「氣體壓力是分子對容器器壁持續不斷撞擊」的結果。
簡單計算氣體分子撞擊x方向的器壁後,該分子的動量變化為
\[\Delta p_x = (-mv_{1x})-(mv_{1x}) = -2mv_{1x}\]器壁同等反向,所以受到的力為 (時間就是反彈後的距離除與速率)
\[F_1 = \frac{\Delta p_1}{\Delta t_1} = \frac{2mv_{1x}}{2L/v_{1x}} = \frac{mv_{1x}^2}{L}\]總和所有分子的撞擊
\[F = \Sigma F_i = \frac{m}{L} \Sigma v_{ix}^2\]這裡就是重點了,我們無法知道真正每個分子的速率,但我們可以引入平均(非時間)的概念,看整陀氣體的平均速率是多少
\[\bar v_x^2 = \Sigma \frac{v_{ix}^2}{N}\]接著因為是隨機方向的運動,取三維平均
\[\Sigma v_{ix}^2 = N \bar v_x^2 = N\bar v^2 / 3\]最後得到
\[F = \frac{mN \bar v^2}{3L}\]壓力
\[P = \frac{N m \bar v^2}{3V}\]引入均方根和密度
\[v_{rms} = \sqrt{\bar v^2} \\ \rho = \frac{Nm}{V}\]壓力最後
\[P=\frac{1}{3}\rho v_{rms}^2\]等號左邊是宏觀的壓力變量,等號右邊則是微觀的分子速率,完美連結了宏觀和微觀!
溫度
一樣地,來看溫度的本質是什麼,先講結論,就是無序(隨機)的氣體平均動能。
接續剛剛壓力的公式
\[P = \frac{N m \bar v^2}{3V}\]重新寫一下
\[PV = \frac{2N}{3}\left(\frac{1}{2}m \bar v^2\right)\]套用理想氣體方程式和平均動能
\[PV = NkT\\ K_{av} = \frac{1}{2}m v_{rms}^2\\ v_{rms}^2 = \bar v^2\]得到
\[\frac{2N}{3}\left(\frac{1}{2}m \bar v^2\right) = NkT\\ \frac{2N}{3} K_{av} = NkT\\ K_{av} = \frac{3}{2} kT\]得到我們前面的結論,溫度就是分子平均動能(translational)的測量值,注意這個平均動能是random的移動,不是有序(闢無說有被風吹過)的。
在進一步看,這個均方根速率就會隨著溫度變化,
\[v_{rms} = \sqrt{\frac{3kT}{m}} = \sqrt{\frac{3RT}{M}}\]所以在同溫度情況下,越輕的氣體,速率越快,但因為同溫度,所以兩者的平均動能相同!
解釋壓縮升溫
第一運動定律知道壓縮會升溫,從氣體動力學來看也是如此,當你活塞往內壓的時候,分子會被活塞撞有了更高的速率(活塞對氣體作功),所以平均速率上升,溫度就上升了。
反過來膨脹,氣體去撞活塞,平均速率下降,溫度就下降。
絕熱自由膨脹
一樣前面講過的絕熱自由膨脹,因為沒有做功,又加上絕熱,氣體的平均速率沒變,溫度也不會變,
提醒一下,等溫膨脹和絕熱自由膨脹的不同,雖然最後溫度都沒變化,但是
- 等溫膨脹有做功,等溫膨脹的溫度不變,是因為外界持續「加熱」來抵銷作功帶來的能量損失。
- 絕熱自由膨脹沒作功(沒東西可推),也沒有熱量交換,溫度不變。
馬克士威 - 波茲曼速率分布
這個在第九節推導過了,這邊舉幾個特點
- 溫度越高,分布的高峰會往右移,波形更寬
- 速率最小是0,但最大是沒有限制的,波形也非對稱
- 地球大氣層的組成跟這有關,雖然氣體平均速率普遍低過地球逃逸速率,但在波形的右邊尾巴,有一小部分的速率非常快,容易達到逃逸速率而離開地球。而越輕的氣體,像是氫氣和氦氣,平均速率較高,也有更多的分布在波形右邊,超過逃逸速率而離開,較重的氣體則相反,所以我們的大氣層中氧氣和氮氣占比相對較多。而月球因為逃逸速率很低,所以氣體幾乎都跑光了,形成不了任何大氣層。
- 一般液體也有一樣的分布,有些分子有較高的動能所以可以克服跟其他分子的吸引力離開表面,就是我們說的蒸散(evaporation),剩下的平均動能比較低,所以溫度就下降了。
Entropy
我們前面知道卡諾循環是
\[\frac{Q_H}{T_H}+\frac{Q_C}{T_C}=0\]現在想像如下的任意可逆的封閉循環(黃色),我們可以切成很多小卡諾循環,每一個循環都是等溫線和絕熱線組成的
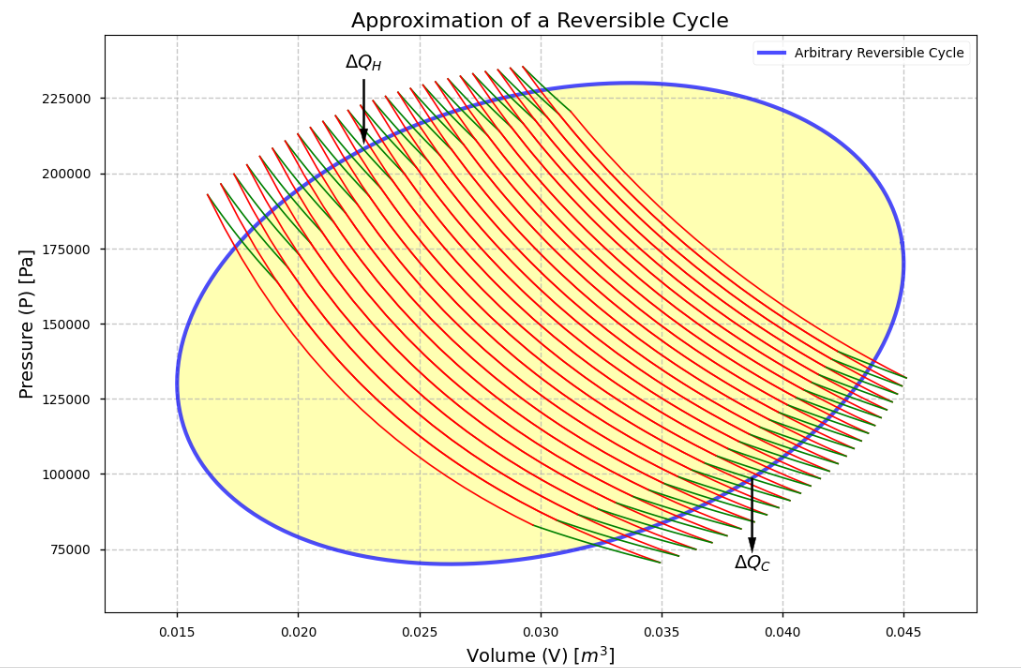
所以每一個循環都滿足
\[\frac{\Delta Q_H}{T_H}+\frac{\Delta Q_C}{T_C}=0\]全部加起來
\[\Sigma \frac{\Delta Q}{T}=0\\ \oint \frac{dQ_R}{T}=0\quad\quad(reversible)\]繞一圈回來等於零的概念,很像我們以前守恆力作功的感覺,只跟兩點狀態有關,跟路徑無關。
所以我們也定了一個狀態函數(Entropy)來描述,注意這裡的Heat一定要是可逆路徑下的
\[dS=\frac{dQ_R}{T}\]所以兩點之間的Entropy變化就是
\[\Delta S = S_f-S_i = \int^f_i \frac{dQ_R}{T}\]The change in entropy depends only on the initial and final equilibrium states, not on the thermodynamic path.
但前面我們都提到是可逆的過程,如果我們要找不可逆的Entopry變化,我們可以在不可逆過程中找到一樣的起始和終止的平衡態,然後套用可逆的路徑去計算(反正Entropy就是一個狀態函數)。
理想氣體可逆過程
直接上結論,Entropy變化為
\[\Delta S = nC_v\ln \left(\frac{T_f}{T_i}\right) + nR \ln \left(\frac{V_f}{V_i}\right)\]因為Entropy只和起始和終點狀態有關,所以這個也可以套用到不可逆過程(只要兩端狀態一樣)
理想絕熱自由膨脹 (不可逆)
一旦戳破膜,氣體會快速膨脹,這時的壓力、體積和溫度沒有唯一定義,所以是不可逆的。
但因為絕熱,所以$\Delta Q =0$
然後之前有說過,對理想氣體
\[\Delta U = 0\\ \Delta T = 0\]所以套用前面熵公式
\[\Delta S = nR \ln \frac{V_f}{V_i} > 0\]那對外界來說,因為絕熱沒有熱交換,所以外界環境的熵沒有變化。
那麼整體來看,系統和外界的熵總和
\[\Delta S_{universe} = \Delta S_{gas} + \Delta S_{env} > 0\]都會大於零。
\[\Delta S \ge 0\]The change in entropy for any process, including an irreversible one, between given initial and final equilibrium states, is the same.
The entropy change in an isolated system is either zero (for a reversible process) or greater than zero (for a real, irreversible process).
熱力學運動定律
The zeroth law of thermodynamics leads to the identification of temperature as a state variable. The first law leads to the concept of internal energy. The second law leads to another state function called entropy.
2nd
熱力學第一運動定律代表的只是能量守恆,任何一種過程(process)都能夠符合。 但是現實生活中,並不是所有過程都會發生,即便他跟能量守恆沒有衝突 譬如說
- 冰塊放進水里不會讓水的溫度上升
- 熱永遠高溫流向低溫,不會低溫流向高溫
- 在水裡溶解的可可粉,不會再攪一攪又收回成一坨
這樣的一種自然常識理解,其實反應著自然過程是有「方向性」的。
這個方向性,就是熱力學第二運動定律。
解釋了
- 熱機效率
- 化學平衡
- 資訊傳遞
- 自然演化方向性
Entropy
對於可逆過程,總熵變化
\[\Delta S = 0\]不可逆過程
\[\Delta S > 0\]所以第二運動定律的另外一種表示就是
\[\Delta S \ge 0\]In a reversible processs the entropy of an isolated system stays constant; in an irriversible process the entropy increases.
基本上現實生活中都是不可逆的,所以全宇宙的熵會一直上升,即便有局部的地方變小,一定會造成其他地方變高。
並且這個跟沒有完美冷機和完美熱機是同樣的意思,因為假設有完美冷機,冷機自己$\Delta S = 0$,熱庫$\Delta S = \frac{Q}{T_H}-\frac{Q}{T_C} < 0$,總$\Delta S <0$,但因為完美冷機不存在,所以$\Delta S>0$一樣還是我們的結論。
除此之外,接下來我們還會看到熵的增加和系統從有序到無序有關,還有熵和機率的關係。
We will see that the principle of increase of entropy is connected with the transition of a system from ordered to disordered states. This in turn iwll lead to a relation between entropy and probability.
能量的分類
從熱力學第一定律知道,所有的熱能都能互相轉換。可是第二定律告訴我們”heat”就不是了。
功能夠100%轉換成熱,但熱不能100%轉換為功(有循環的cycle)。
為什麼呢?
因為功是有序的(ordered motion),在一個系統的所有運動可能性裡,成為某種有序組合方式非常少,但要轉換為熱時(熱是一種無序微觀交互作用的過程)這個無序的組合方式就非常多,從可能性很小的極低機率中轉換成可能性很高的極大機率狀態,在統計力學裡,是一種非常”理所當然”的事情。
然而反過來的,熱要轉換為功,從無序到有序,就只能部分轉過去了,大部分的熱還是都會變成廢熱排走,從機率的角度來說也是一樣的解釋狀態。
這裡再額外提一點,我們之前在算熱力學第一定律的時候,沒有算到質心運動,而涉及到質心運動一定是有序的,因為所謂的無序運動,可以想像速度(向量)各自方向都有,雖然算能量(二次方)時是有的,但你算全部速度會是0(因為各個方向抵銷),這樣的無序無法作功,就像推一個活塞,兩側都有撞,活塞還是不會動的。
但如果有質心運動,譬如說把一個裝滿氣體的箱子往外丟,裡面一樣無序,但整個箱子整體有一個特定方向移動,所以可作功,能量也會在多這個動能。
Therefore, although complete conversions among electrical, chemical, mechanical, and other forms of energy are possible, the use of mechanical work to generate heat always means that some energy becomes unavailable to do work. This is because internal energy cannot be completely converted to other forms or fully used to do work, and often called “low-grade”. The ordered kintetic energy of the center of mass motion of a car is “high-grade” energy.
The degradation of energy is associated with the transition of the system from an ordered to a disordered state. In any natural (irreversible) process, some energy becomes unavailable to do usefule work.
接下來把這個概念和熵結合在一起
- 一般功轉熱(有序到無序),像是摩擦生熱,因為功是有序的,熵為零(可參考波茲曼公式),但會有一個熱庫吸收熱,不管這個熱庫溫度多少,dS = dQ/T > 0,那麼總熵一定是上升的。
- 一般大自然常見高溫到低溫過程,中間不管有什麼引擎,一定是有兩個熱庫,高溫放熱,低溫吸熱,所以 $\Delta S = -Q/T_H + Q/T_C > 0$,總熵也一定會上升。
- 一般熱機,可以看見第二點之所以熵一定會是正的,是因為有兩個熱庫(低溫的那個吸熱得正),那為什麼我們一般說的熱機都也要有兩個熱庫呢?是因為我們的引擎要循環!當引擎從熱庫吸熱做功之後,會需要另外一個冷庫幫忙回到原始狀態(譬如說蒸汽機需要額外輸入冷卻水),所以一定會有個低溫熱庫去吸熱,來讓最後的總熵仍然是上升。
- 單純熱轉功:那你說,不要循環了,我直接只有一次熱轉功可不可以?也可以,熱庫放熱是負的,但是作功的系統會吸熱轉成功,所以最理想的情況頂多總熵沒有變化。
那麼從第一點可以比較容易看到,熵越高,越亂(無序)。
那麼第二和第三點呢?雖然總熵也越高,但這個亂怎麼看?
先說,從高溫到低溫的過程,同樣一份熱,可以降低高溫系統亂度的效果,小於,提高低溫系統亂度的後果。
這裡背後跟量子力學的能階有關係,更進一步地說,越高溫(能階越高)可以處在的狀態可能性越大,同樣一份100J的熱,失去這份熱,可能只能讓系統的粒子下來一點,只是把一些最高能量的可能性變空了,但大家還是都在很亂的狀態裡玩。可是對低溫來說,本來處在的狀態可能性就小,即便你只給他一點點100J的熱,他一有機會提升,那麼可以玩的廣度就多了,各種可能性都有,所以就更亂了。
熱寂
所以,熱力學第二定律我們常常說是”time’s arrow”,因為自然不可逆過程就是如此,整個宇宙就是越來越亂,總熵一直上升,直到一切都達到熱平衡(不在有熱交換和熵的變化)為止,我們稱為 heat death(熱寂)。
熱力學與力學的悖論
從以上我們知道,熱力學第二定律是有方向性的,不可逆轉。
可是我們以前學的力學,是有時間反轉不變性的(time-reversal invariant),一顆球碰撞前後的速度不一樣,但你倒過來播影片也不覺得有什麼差,或是行星軌道換另外一個方向繞你也覺得沒什麼奇怪。
那麼為什麼呢?
微觀粒子遵循力學是可逆的,但是宏觀系統的大自然遵循熱力學卻是不可逆的?
先說答案,因為不可逆的機率最大,系統自發地從無序變回有序的機率還是有的,但實在小到太難發生(要等$10^100$年才會碰到),而且會很快就又回到最大機率的亂。
這就要再來提一下所謂有序和無序,以及機率之間的關係了。
想像我們有 4 枚硬幣,定義宏觀和微觀狀態
| 宏觀狀態 | 微觀狀態 | 機率 |
|---|---|---|
| 4H | HHHH | 1/16 |
| 3H | HHHT, HHTH, HTHH, THHH | 4/16 (1/4) |
| 2H | HHTT, HTHT, HTTH, THHT, THTH, TTHH | 6/16 (3/8) |
| 1H | HTTT, THTT, TTHT, TTTH | 4/16 (1/4) |
| 0H | TTTT | 1/16 |
每一種微觀狀態出現機率都一樣,但是不同的宏觀狀態,機率卻差很多
- 「4 個正面」 是最整齊、最有序的狀態,它只有 1 種組合方式 (正正正正),所以機率最低 (1/16)。
- 「2 正 2 反」 是最亂、最無序的狀態,它有 6 種組合方式,所以機率最高 (3/8)。
統計學裡也知道
- 當你投擲的次數越多,越接近這個統計結果。
- 當你參與的硬幣越多,最亂的的的機率將會超級高,像是一個很尖的peak。
回到我們自然的日常生活,像是氣體,微觀代表
- 形容一個粒子的位置和速度
宏觀則是
- 形容一坨粒子的壓力、體積和溫度
所以若說要氣體中的所有分子速度瞬間反轉,從較無序的狀態演變回較有序的狀態,熵確實有可能會減少,但系統會很快又回到亂度更大、機率更高的狀態。以一個容器中的 $10^{23}$ 個粒子為例,它們全部被發現在一半空間中的可能性並非不可能,但這種情況發生的機率是如此之小,以至於我們可能要等待比宇宙年齡長 $10^{100}$ 年的時間才能遇到它!
Entropy and Probability
我們在來看一下之前絕熱自由膨脹的熵變化
\[S_1-S_2=k\ln \left(\frac{V_1}{V_2}\right)^N\]假設今天只有一個氣體都要待在左側,那機率就是1/2。兩個都在左側,就是$(1/2)^2$,以此類推,N個待在特定的比例就是$(V_1/V_2)^N$。
所以轉換一下,設$S_2$ = 0,那麼就能簡化為波茲曼公式
\[S=k\ln W\]$W$就是某個微觀狀態的總數,這個數值與該狀態發生的機率成正比,可以看到這個公式把微觀世界和宏觀的$S$結合在一起!
